Livet er utenkelig uten flytende vann. Livet oppsto i vann, og alle livets riker har sin opprinnelse i vann. Det å komme opp av vannet og utvikle seg på tørt land har vært en av evolusjonens store milepæler; enten det gjelder planter, sopp eller dyr. Og uansett vil organismer som bebor sjøl de tørreste strøk av Jorda være avhengig av vann. Astronomer som leter etter mulig liv på andre planeter, leter først og fremst etter vann. Derfor blir overskriftene store når det blir påvist noen få vanndråper på Mars. Og det spekuleres vilt om hva som måtte skjule seg i vannet under islaget på Europa, en av Jupiters store måner.
Hva er det som er så spesielt med vann? Vi tenker sjelden over at noe så dagligdags er en fysikalsk-kjemisk merkverdighet. Men hvorfor er is lettere enn vann, hvorfor er vann tyngst ved 4 °C, hvorfor har det så stor varmekapsitet? Dette er bare noen av mange spørsmål.
Ser vi på de forbindelsene det vil være naturlig å sammenlikne vann med med hensyn til oksygenets plassering i det periodiske system, skjønner vi fort at vann stiller i en særklasse. Ved siden av vann H2O finner vi ammoniakk NH3 til venstre og hydrogenfluorid HF til høyre. Og sjøl om disse stoffene deler noen av vannets egenskaper, er de ingen fullgode erstattere.
Ammoniakk er en gass med basiske egenskaper. Først ved -33,34 °C går den over til væske. Flytende ammoniakk har noen av vannets egenskaper, men langt fra alle. Det har riktignok vært spekulert om liv på andre planeter kan bruke flytende ammoniakk istedenfor vann, men det har aldri vært framlagt noen god hypotese for hvordan.
Hydrogenfluorid er er en gass med klart sure egenskaper og som går over til væske nesten ved romtemperatur, dvs. 19,54 °C. Stoffet har også mange av vannets egenskaper, danner f.eks. dipol-dipol-bindinger over hydrogen (se seinere), men er likevel umulig å tenke seg som basis for noe levende. For jordiske organismer er hydrogenflurid sterkt toksisk, og man må ha god fantasi for å kunne forestille seg liv basert på flytende hydrogenfluorid. Og om slikt liv rent hypotetisk kunne tenkes, er det så vidt lite fluor i Universet at vi neppe kan forestille oss noen planet med sjøer av hydrogenfluorid istedenfor vann. Hydrogenfluorid reagerer dessuten med kvarts og andre silikatmineraler og vil ikke være stabilt på planeter med silisiumbasert geologi.
Under oksygen i det periodiske system finner vi svovel, som på mange måter er det elementet som likner mest på oksygen. Vannets ekvivalent er hydrogensulfid H2S, en stinkende, giftig gass med svært få av vannets egenskaper og med kokepunkt -60,28 °C. Den eneste biologiske likheten mellom vann og hydrogensulfid er at begge kan være elektrondonor i fotosyntese, sistnevnte riktignok bare hos visse bakterier med bakterieklorofyll.
Vannet er altså omgitt av stoffer som er gasser der vann er væske..
Vannets spesielle egenskaper ligger i vannmolekylets polare natur. Oksygenet er sterkt elektronegativt (nest etter fluor) og trekker på hydrogenatomene slik at de danner vinkel på oksygenatomet. Vannmolekylet får derfor en negativ tendens i oksygen-enden og en positiv tendens der hydrogenatomene sitter. Dette gjør at hydrogenatomene i vannmolekylet kan danne hydrogenbindinger til de hosliggende oksygenatomene i nabomolekylene og inngå i det som kalles dipol-dipol-bindinger. Disse bindingene er så sterke at vann opptrer som væske ved temperaturer der vi ved rent kjemiske betraktninger burde ha forventet en gass. (Hos hydrogensulfid, der også hydrogenatomene danner vinkel, er svovelatomet for stort og for lite elektronegativt til at det kan oppstå hydrogenbindinger.)
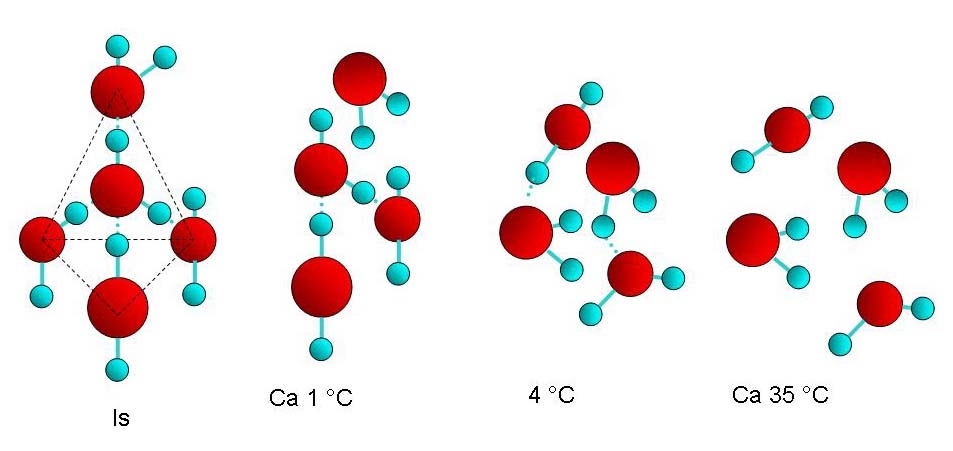
Hos vann i fast form, dvs. is, inngår disse bindingene i en pyramideformet, tetraedrisk struktur av fire vannmolekyler. Denne bygningen gjør at is får en mer åpen struktur enn flytende vann hvor molekylene ikke blir bundet opp i rigide tetraedere. Og derfor er is lettere enn vann og utvider seg. Og derfor smelter is ved trykk (fordi molekylene og derved tetraederstrukturen presses sammen) og gjør at skiene og skøytene glir. Dette er også årsaken til at iskrystaller er sekskantene, fordi den tetraedriske strukturen gir sekskantete prismer.
Vann mellom 0 og 4 °C oppfører seg fysikalsk-kjemisk som noe mellom is og vann. Nær frysepunktet er mye av den rigide tetreadriske dipol-dipol strukturen fortsatt i behold. Når vi nærmer oss 4 °C, svekkes dipol-dipol-bindingene gradvis, og ved 4 °C utlignes effekten fra dipol-dipol-bindingene fordi varmen samtidig får molekylene til å bevege seg fra hverandre. Ved denne temperaturen blir derfor vannet tettest og tyngst. Ved høyere temperaturer spiller bevegelsen større rolle enn dipol-dipol-bindingene, og vannet blir lettere og lettere. Over 35 °C er praktisk talt alle de tetraedriske strukturene borte.
Derfor har vannet også stor varmekapasitet fordi en del varme også går med til å bryte dipol-dipol-bindingene ved siden av å gi bevegelsesenergi til molekylene. Tenk bare på hva dette betyr for kimaet på Jorda. Det vintermilde kystklimaet kommer nettopp av havvannets evne til å holde på varmen. Ved 35 °C er varmekapasiteten minst. Legg merke til at temperaturen til varmblodige dyr ligger omtrent her eller litt høyere. Dette gjør varmereguleringen enklere.
Og husk på at vann er en av de ytterst få væsker som fryser ovenfra og ned - nettopp på grunn av nevnte egenskaper. Hadde vannet frosset fra nedenfra og opp, ville alt liv i vann vært utenkelig, iallfall på en planet med jordisk klima!
Men adre ord: okygenatomets sterke elektronegativitet og lille størrelse gjør livets kilde mulig.
Videre lesning: Cartlidge, E. 2010. A drop of the weird stuff. New Scientist 6. February 2010, 32-35.




Logg inn for å kommentere
Ikke UiO- eller Feide-bruker?
Opprett en WebID-bruker for å kommentere