Luftforurensninger, radikaler og planter
ærre Tider; Syner gjennom Fremtidsnatten lyner! Brittens kvalme Stenkulsky sænker sort sig over Landet, smudser alt det friske grønne, kvæler alle spirer skønne, stryger lavt, med Giftstoff blandet, stjæler Sol og Dag fra Egnen, drysser ned, som Askeregnen over Oldtids dømte By. Fra Henrik Ibsen Brand (1866).
Svoveldioksid
Jordas atmosfære er oksiderende. Svoveldioksid og nitrogenoksid fra forbrenning kommer ned med nedbøren som henholdsvis svovelsyre og salpetersyre. Grunnen er at SO2 og NOx som slippes ut i atmosfæren oksideres fotokjemisk i gassfase/væskefase ved hjelp av radikalene:
- OH· hydroksylradikal
- HO2· hydroperoksylradikal
Hydroksylradikalet er blitt kalt atmosfærens vaskemiddel. Uten dette ville vi hatt en stinkende illeluktende atmosfære.
Svoveldioksid skader på planter er blitt mindre utbredt i de siste årene pga. rensetiltak i industrien. Svoveldioksid (SO2) kommer fra oksidasjon (forbrenning) av svovelrikt brensel (kull, olje), fra smelteverk, vulkansk aktivitet og utskilt fra havet bla. som dimetylsulfid. Størsteparten av svovelutslippene i Norge kommer fra kopperverk, jernverk, aluminiumverk, ferrolegeringindustri, treforedling, raffinering og oppvarming, men er betydelig redusert i forhold til tidligere tider.
Svoveldioksid oksideres i atmosfæren til sulfat, og det blir dannet svovelsyre. Salpetersyre kommer fra oksidasjon av nitrogenoksider, som begge disse bidrar til jordforsuring. Oksidasjonen kan skje fotokjemisk i gassfase ved hjelp av hydroksylradikalet (OH×) eller hydroperoksylradikalet (HO2×). F.eks.
![]()
Oksidasjonen kan også skje i væskefase, enten fotokjemisk vha. f.eks. ozon og hydrogenperoksid eller katalyttisk vha. metaller som jern (Fe) og mangan (Mn). En mekanisme som også tar for seg oksidasjon av nitrogenoksider kan være som følger:
Svoveldioksid løses i vann og gir svovelsyrling (H2SO3) i syrebaselikevekt med bisulfitt (HSO3-) og sulfitt (SO3-). Det er sannsynligvis disse som gir de skadelige effektene i plantene.
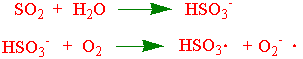
Sulfitt kan spalte disulfidbindinger. Forøvrig tenker man seg en fri radikal reaksjon. En av responsene på svoveldioksid er økt aktivitet av superoksid dismutase. Svoveldioksid gir redusert fotosyntese. Svoveldioksid kan tas opp igjennom spalteåpningene og fungere som svovelkilde for planter hvis det er dårlig tilgang på sulfat fra jorda.
Sur nedbør øker tilførselen av nitrogen og svovel, men reduserer samtidig tilgangen på basekationene kalium, kalsium og magnesium ved utbytting med protoner. Når sulfattilførselen overstiger behovet tar sulfat med seg basekationene og vasker disse ut av jorda. Analogt gjelder for overskudd av nitrat.
Nitrogenoksider
79 % av atmosfæren er nitrogengass. N2O, NO og NO2 er nitrogenoksider, og NH3 og NH4+ er redusert nitrogen som også finnes i atmosfæren. Nitrogenmonooksid (NO) og nitrogendioksid (NO2) angis sammen som NOx. Hovedutslippskildene av nitrogenoksider er fra bil- og kysttrafikk og ved forbrenning av olje og kull. Nitrogenoksider kan også produseres ved elektriske utladninger i atmosfæren (lys) og ved anaerob bakteriell virksomhet. NOx er lite løselig i vann og oksideres vesentlig i gassfase. Damptrykket gjør at det er mye salpetersyre i gassfase i forhold til svovelsyre. NO og NO2 kan også disproporsjonere til salpetersyre og salpetersyrling.
Konsentrasjonen av lystgass (N2O) i atmosfæren (med levetid >100 år) øker og bidrar til svekkelse av ozonlaget. Lystgass dannes bl.a. ved denitrifikasjon i anaerob jord. NO er et radikal som hemmer cytokrom c-oksidase hos planter, men ikke den alternative oksidasen. NO gir spiring av frø etter brann. NO kan også lages i planten fra aminosyren arginin katalysert av enzymet NO-syntase. Nitrogenoksider gir planteskader. NO gir redusert vekst sannsynligvis fordi det er et radikal (·N=O), og gir opphopning av nitritt i planten. NO oksideres sakte av oksygen til NO2, men meget raskt av ozon.
Stratosfæreozon
Ozonlaget i stratosfæren beskytter jorda mot skadelig ultrafiolett stråling, og opptil 99% av solas UV-stråling tas opp av ozon-oksygensyklus. Fotodissosiasjon av oksygen med ultrafiolett lys gir to oksygenatomer og virker som en skjerm mot UV-stråling.
Klorfluorkarboner (KFK, freoner) og lystgass (N2O) påvirker ozon-oksygensyklus.
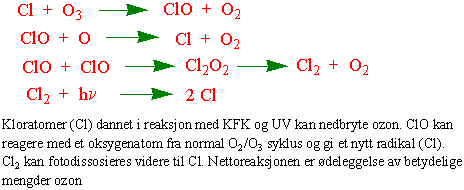
Nettoreaksjonen er ødeleggelse av betydelige mengder ozon. Polare stratosfæreskyer, skyer av salpetersyre- (HNO3-3H2O) og svovelsyreis antas å delta i prosessen ved Antarktis. I tillegg finnes det brom i stratosfæren som også kan innvirke.
En Dobson-enhet er tykkelsen ozon vil innta hvis den ble samlet sammen i en tynn hinne som dekker jorda ved atmosfæretrykk og er 10 mm tykk. 200-400 Dobson-enheter vil si et 2- 4 mm tykt ozonlag hvis det var ved havnivå. Normalt for atmosfæren er 350-450 DU.
Fotokjemiske oksidanter
Fotokjemiske oksidanter er oksiderende stoffer i atmosfæren - ozon (O3), hydrogenperoksid (H2O2), hydroksylradikal (OH Ozon i troposfæren (bakkenært ozon) dannes under naturlige betingelser i en ozonsyklus som gir bakgrunnsverdiene for ozon. Atomært oksygen reagerer med dioksygen og danner ozon: ×) og peroksyacetylnitrat (PAN). Ozon er den viktigste av disse. Navnet fotokjemisk angir sollysets betydning i disse reaksjonene.

O (3P) - atomært oksygen (triplett) dannes ved fotokjemisk spalting (fotolyse) av nitrogen dioksid for lys med lavere bølgelengde enn 420 nm. M er et tredje molekyl som stabiliserer det eksiterte intermediatet. NO reagerer raskt videre med ozon. Ozonepisoder med økende ozonkonsentrasjoner i troposfæren oppstår når nitrogenmonooksid (NO) reagerer med andre stoffer i atmosfæren enn ozon. Dette er stoffer som skyldes luftforurensninger bl.a. peroksyradikaler av typen hydroperoksy (HO2·), og metylperoksyl (CH3O2·). Peroksyradikalene kommer fra andre stoffer i atmosfæren som alkaner, alkener og aldehyder (bl.a. formaldehyd).
Flyktige organiske karbonforvindelser
Flyktige organiske karbonforbindelser i atmosfæren (VOC) som er nødvendig for dannelsen av ozon kan være antropogene eller biogene. Planter skiller ut store mengder terpener. Dessuten skiller de ut isopren laget fra dimetylallyldifosfat katalysert av enzymet isopren syntase. Acetaldehyd kan skilles ut fra blader fra planter og trær hvor røttene vokser anaerobt. Etanol i røttene dannet ved etanolgjæring fraktes via xylem og floem og oksideres i bladene til acetaldehyd og edikksyre. Sollys er nødvendig for radikaldannelse i atmosfæren. Det kan forventes at radikaldannelsen øker hvis det beskyttende ozonlaget i stratosfæren reduseres, og i tillegg øker de direkte UV- skadene
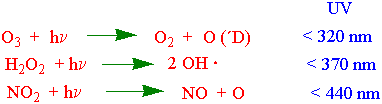
Ozon kan være med å øke de oksiderende prosesser i planten
Oksygen som et resultat av spaltingen av vann i fotosyntesen danner grunnlaget for utviklingen av de fleste av artene som lever på jorda. I atmosfæren antar man at det finnes ca. 37 Emol oksygen (1Emol=1018 mol) og i havet løst ca. 0.4 Emol oksygen. Oksygen finnes bl.a. også bundet til silisium. Oksygen deltar i celleåndingen (respirasjonen) ved å motta elektroner, og er en kraftig oksidant. Oksygen kan oksidere transisjonsmetallene jern (Fe2+), mangan (Mn2+) og vanadium (V4+). I noen tilfeller dannes superoksidanionradikalet (O2-·), hydroperoksylradikalet (HOO·), og hydroksylradikalet (OH·). Hydroksylradikalet er en meget kraftig oksidant. Oksygen er det 8. elementet i det periodiske system. Vi kan si at oksygen i grunntilstanden er et biradikal. Superoksidradikalet er i pH likevekt med hydroperoksylradikalet (HO2×) med pKa-verdi 4.8.
Hydrogenperoksid er ustabil og disproporsjonerer til oksygen og vann. Superoksidradikalet er også utstabilt og disproporsjonerer til oksygen og hydrogenperoksid. Superoksidradikalet kan både oksidere og redusere transisjonsmetaller:
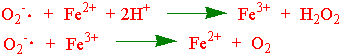
Superoksidradikalet kan derved være med i en syklisk omsetning av jern. Hydrogenperoksid ( H2O2) kan omdannes til hydroksylradikalet (OH×) ved overføring av elektroner fra toverdig jern.
Hydroksylradikalet (OH×) kan også dannes ved radiolyse av vann:
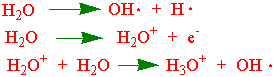
I et reagensglass kan vi få dannet Fentonreaksjon og Haber-Weiss reaksjoner med jernchelater:
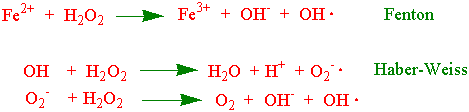
Hydroksylradikalet kan hydroksylere en rekke aromatiske forbindelser. For eksempel vil Fe2+-chelat hydroksylere salicylsyre til 2,3- dihydroksybenzosyre, 2,5-dihydroksybenzosyre og catechol. 4-hydroksybenzosyre blir hydroksylert til 3,4-dihydroksybenzosyre og hydrokinon. Xanthin oksidase er et enzym som produserer superoksidradikaler:
![]()
Tålegrensene for ozon sett i relasjon til planter er satt til 150 mg m-3 som timesmiddel. AOT40 (accumulated exposure over a threshold of 40 ppb) er en annen måte å angi tålegrense (ECE) for ozon. Denne beregnes ved å summere forskjellen mellom timesmiddelkonsentrasjon og 40 ppb for hver time som overstiger en ozonkonsentrasjon på 40 ppb.
Enheten på AOT40 er ppb×h eller ppm×h og det er foreslått forskjellige tålegrenser for forskjellige vegetasjonstyper . F.eks. AOT40 lik 10 ppm×h for skog i vekstsesongen og AOT40 lik 700 ppb×h for landbruksvekster. De eldste bladene på en plante er de som viser først synlig skade etter en ozoneksponering.