Kjemisk potensial og vannpotensial
Vann beveger seg fra høyt til lavt potensial
- Kjemisk potensial
- Gravitasjonspotensial (Høydepotensial)
- Konsentrasjon og aktivitet
- Vannpotensial
- Osmotisk potensial
- Trykkpotensial
- Matrikspotensial
- Vannpotensial i luft
- "Det er mer vann i agurk, enn det er vann i sjøvann"
Kjemisk potensial
Det finnes mange forskjellige typer potensialer: gravitasjonspotensial (høydepotensial), redokspotensial, kjemisk potensial og vannpotensial. I alle disse potensialene har man en referanseverdi som settes lik 0. Vannpotensial er et begrep som brukes til å forklare vanntransport i planter. Et annet begrep som kan benyttes er vannkonsentrasjon. Kjemisk potensial µ (mu) er mengden fri energi for et stoff som er tilgjengelig for å utføre arbeid. Minskningen i fri energi for stoffet er lik den maksimale energien som er tilgjengelig for arbeid. Fri energi minsker ved spontane prosesser (konstant trykk og temperatur). Forskjellen i kjemisk potensial blir et mål for drivkraften for bevegelsen av et stoff. Jo større forskjell i kjemisk potensial, desto raskere forandring. Det kjemiske potensialet er avhengig av grad av orden (entropien) til systemet. Det kjemiske potensialet blir derfor avhengig av konsentrasjon, trykk og elektriske ladninger. F.eks. vil det elektriske potensialet påvirke det kjemiske potensialet til ladete partikler. Et kation vil bevege seg mot katoden, dvs. mot stedet med lavest elektrisk potensial.
Det kjemiske potensialet er et relativt mål dvs. det må uttrykkes relativt til et visst referansenivå. Det kjemiske potensialet kan ikke bestemmes , men vi er som regel ute etter å se på forskjellen i kjemisk potensial mellom to steder. Da har det ingen betydning at man ikke kjenner de absolutte verdiene. Når vann beveger seg blir det utført arbeid. Energiinnholdet til vann og andre stoffer kan beskrives av det kjemiske potensialet. Det kjemiske potensial (m) er mengden fri energi per mol stoff.
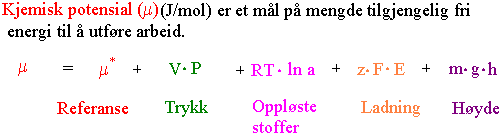
*m er referanse. R er gasskonstanten 8.314 J× mol-1 × K-1. T er absolutt temperatur (K). ln er naturlig logaritme. a er aktivitet som er lik konsentrasjon ganger en aktivitetskoeffisient. V er partielt molart volum. P er trykk. m er massen til ett mol stoff. g er gravitasjonskonstanten 9.806 m×s-2 . h er høyde. z er ladning. F er Faradays konstant 96.480 J× V-1× mol-1. E er spenning.
Det kjemiske potensial er bestemt av konsentrasjon, trykk, høyde og ladning. Når det gjelder vann kan vi se bort fra ladning fordi selv om vannmolekylet er en dipol er netto ladning lik 0.
Gravitasjonspotensial (Høydepotensial)
Enheten for arbeid er joule. Gravitasjonskreftene som trekker på massen nedover er på jorda lik 9.81 N ved havoverflaten. Det betyr at å løfte en masse på 1 kg 1 m høyt vil trenge 9.81 J. 1 J = 1 Nm. Det betyr at 1 J tilsvarer å løfte ca. 100 g i en høyde på 1 m.
For å løfte en viss mengde vann (mv) en høyde (h) må det utføres et arbeid (W) som er lik kraft x vei. Kraft er lik masse x tyngdens aksellerasjon (g= 9.81 m s-2=9.81 N kg-1). Potensiell energi (W) på grunn av tyngdekraften blir:
![]()
hvor m er masse og g er tyngdens aksellerasjon.
Den potensielle energien til 1 mol vann via den molare massen ( mv=0.018016 kg mol-1) gir gravitasjonspotensialet (h). y
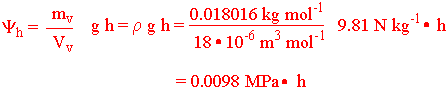
v er tettheten til vann. r
Det betyr at det kjemiske potensialet til vann (ett mol) øker med ca. 0.01 MPa per meter. Gravitasjonspotensialet har mindre betydning for bevegelse av vann og ioner i en plantecelle, men er viktig for bevegelsen av vann hvor det er høydeforskjeller f.eks. i et høyt tre. Trykket under vannoverflaten stiger med en atmosfære for hver 10 m man befinner seg under havoverflaten (Pascals lov).
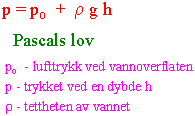
Konsentrasjon og aktivitet
Vi bruker ofte aktivitet (a) i stedet for konsentrasjon (c). Dette er spesielt viktig i konsentrerte løsninger. Sammenheng mellom aktivitet og konsentrasjon er :
![]()
hvor er aktivitetskoeffisienten. Aktivitetskoeffisienten er det tallet som vi må multiplisere molariteten (eegentlig molaliteten) med for å få aktiviteten. Aktiviteten er som regel mindre enn konsentrasjonen. For høyere konsentrasjoner enn 10-4 M er aktiviteten betydelig mindre. Aktivitetskoeffisienten er alltid mindre enn 1 for ladete stoffer. Den er ca. lik 0.7 for enverdige ioner og ca. 0.3 for toverdige ioner. For en 0.3 M glukoseløsning er aktivitetskoeffisienten lik 0.96. Både Brønsted, Debye og Hückel studerte elektrolyttenes kjemi og kom fram til at aktivitetskoeffisienten varierte med kvadratroten til ionestyrken. Slike studier baserte seg på løseligheten av salter i elektrolytter med forskjellige konsentrasjoner. Ionestyrke I er gitt ved:
![]()
hvor c er molariteten og z er valensen av hvert ion i løsningen. F.eks. 0.01 M Na2SO4 har ionestyrke: I = 1/2(0.01×12 + 0.01× (-2)2)= 0.025
Vannpotensial
Det har ikke vært lett å enes om et begrep som kan beskrive vannets “tilstand” med termodynamiske måleenheter. I 1960 introduserte plantefysiologene Slatyer og Taylor begrepet vannpotensial for å kunne beskrive hvilken vei vann vil bevege seg mellom to systemer som er forbundet med hverandre. Vannpotensialet sier noe om innhold av fri energi i vannet og mengden fri energi er et mål på evnen til å kunne utføre arbeid. Vannpotensialet er også brukt som et mål på vannstatus i planten.
Vannpotensialet ( (psi)) er det kjemiske potensialet til vann (uttrykt som energi per mol) dividert med molvolumet for vann (Vv (18 cm3 mol-1= 18 ml mol-1)). Vannpotensialet får derved enheten trykk (pascal), men husk at den opprinnelige enheten er energi per mol. I eksemplet nedenfor er molvolumet oppgitt i enheten m3mol-1. En J per mol vann tilsvarer 55.56 kPa.
Trykk er kraft per areal , altså Nm-2, målt i enhet pascal (Pa). 1 bar= 100 kPa = 0.1 MPa= ca. 0.987 atmosfærer. Vanlig lufttrykk er 0.1013 MPa = 1.013 bar = 760 mm kvikksølv). De tilsynelatende paradoksalt høye pascal-verdiene ligger implisitt i den høye molariteten til vann (55.56 M) og det lave molvolumet. Å dividere på molvolum for vann er ikke uproblematisk når man beregner vannpotensial, siden molvolumet ikke er noen konstant, men endrer seg med sammensetningen av løsningen og med temperaturen. For tynne løsninger ved biologisk temperatur antas feilen å utgjøre mindre enn 1 prosent.
Vannpotensialet til et isotermt system i væskefase består av:
1) Osmotisk potensial (s) (solut potensial l. solutus - fri, løs) som skyldes oppløste stoffer.Det osmotiske potensialet s er synonymt med . I noen bøker brukes begrepet osmotisk trykk () i stedet for osmotisk potensial, men disse har bare forskjellig fortegn (s =-). Omotisk trykk kan måles i et osmometer. YYYppYp
2) Trykkpotensial (p), også kalt hydrostatisk trykk.Y
3) Høydepotensial (h) hvis det er høydeforskjeller i systemet som betraktes. Høydepotensialet er 0.0098MPa m-1.Y
Vannpotensial framkomme fra uttrykket hvor kjemisk potensial er dividert på molvolumet for vann.

Potensialer har ofte en referanse som settes definisjonsmessig lik 0. Rent vann uten kontakt med noe matriks og ved atmosfæretrykk og temperatur lik omgivelsene brukes som referanse og har vannpotensial lik 0. Vann vil alltid bevege seg til det stedet som har lavest (mest negativt) vannpotensial - fra høyt til lavt potensial - fra høy til lav fri energi. Vannet beveger seg langs en gradient i vannpotensial. Siden vanntransporten er passiv må vannpotensialet inne i rota være lavere enn vannpotensialet i jorda.
Osmotisk potensial
Det osmotiske potensialet angir effekten på vannpotensialet av oppløste stoffer og blir for oppløsninger mindre enn 0 og for rent vann lik 0. Vi kan bildemessig tenke oss en oppløsning hvor de oppløste stoffene blir omgitt av vannmolekyler. Vannmolekylene som er opptatt med binding rundt oppløste stoffer kan ikke delta i arbeid som de andre frie vannmolekylene. Derfor har en oppløsning mindre evne til å utføre arbeid enn rent vann ved de samme ytre betingelsene. Oppløste stoffer reduserer den fri energien til vannmolekylene ved å øke entropien. Oppløste stoffer reduserer vanndamptrykket over løsningen, og senker frysepunktet og hever kokepunktet. Vann koker når vanndamptrykket over løsningen er lik lufttrykket. RT× lna uttrykker osmotisk potensial. Det osmotiske potensialet kan gi et osmotiske trykk hvis det settes sammen i et osmometer. For tynne løsninger som inneholder ikkedissosierende stoffer er det osmotiske potensialet tilnærmet proporsjonalt med konsentrasjon av oppløst stoff dvs. tilnærmet gjelder van't Hoffs empiriske oppdagelse (1887):
![]()
hvor cs er konsentrasjon av osmotiske aktive partikler i mol per liter (mol L-1 ) uttrykt som osmolalitet dvs. hvor mange mol osmotisk aktive partikler. F.eks. 0.1 M sukrose gir 0.1 mol osmotiske aktive partikler per liter, mens 0.1 M NaCl gir 0.2 mol osmotiske aktive partikler per liter (avhenger av dissosiasjonsgrad).
En ideell 1 molal løsning gir et osmotisk trykk på 2.479 MPa ved 25oC Hvis cellesaften inneholder ca. 0.3 mol osmotiske aktive stoffer per kg vann har vi en 0.3 osmolal løsning. F. eks. 0.1 molal CaCl2 er ca. 0.3 osmolal.
osmolaritet = molalitet × nf
- n- antall partikler som molekylene dissosierer i
- f - osmotisk koeffisient (mål på avvik fra vann)
- 1 osmol kg-1 = 8.32 T kPa
Frysepunktdepresjon er ca. 1.86 oC for en 1 osmolal løsning (ikke elektrolytt).
Trykkpotensial
Trykkpotensialet angir hydrostatisk trykk til løsningen. Det hydrostatiske trykket kan være større, mindre eller lik 0. Når trykkpotensialet er positivt inne i en celle kalles det turgortrykk. Det er et positivt trykk mot celleveggen som skyldes høy konsentrasjon osmotisk aktive stoffer i cytoplasma og vakuole. Når det er negativt hydrostatisk trykk i en celle f.eks. døde celler i xylem kalles det tensjon. Slik tensjon er det også i celleveggene som vender mot intercellularrommene i bladene. Det hydrostatiske (turgor) trykket er oftest positivt i parenkymatiske celler. I vedrør og trakeider er det hydrostatiske trykket mindre enn 0 (tensjon) så lenge som luften omkring planten ikke er mettet med vanndamp.Ved atmosfæretrykket settes P=0 slik at man regner eventuelle forskjeller fra atmosfæretrykket. Er P=1 betyr dette en atmosfære utover atmosfærtrykket, altså 2 atmosfæreres trykk. Trykkpotensialet kan være større, mindre eller lik 0. P.g.a celleveggen vil det kunne bygges opp et stort hydrostatisk trykk i plantecellen. Vær oppmerksom på at ved absolutt vakuum vil trykkpotensialet ha verdien -0.1 MPa (P=-1), mens absolutt trykk er 0 Mpa.
Sukkerbete, sukkerrør og vindruer har lavt osmotisk potensial ned til -2.5 MPa. Halofytter har også lavt osmotisk potensial i rotcellenefor å redusere vannpotensialet slik at de lettere kan ta opp vann fra sjøvann. Vanligvis er osmotisk potensial fra -0.8 til -1.2 MPa i planteceller.
Høydepotensial
Vann vil renne nedover pga. gravitasjonskreftene hvis det ikke er en motvirkende kraft. Høydepotensialet lik 0.0098 MPa×m-1. Siden atmosfæretrykket ved havnivå er lik 0.1013 MPa ser man at atmosfæretrykket kan holde oppe en vertikal vannsøyle på ca. 10.3 m. Det samme som 760 mm kvikksølv. Derfor klarer ikke en sugepumpe som arbeider ved atmosfæretrykk å pumpe vann høyere enn ca. 10.3 m.
Matrikspotensial
For geler og overflater gjelder ikke van't Hoffs lov. Vi kan her snakke om et matrikspotensial . Matrikspotensialet i.f.m. overflater har ikke har noe eget ledd i uttrykket for det kjemiske potensialet. Generelt vil overflater redusere aktiviteten til vann. Matrikspotensialet spiller en stor rolle for vannforholdene i jord, cellevegger og imbibisjon av frø, og angir reduksjon i fri energi til vannmolekylene i ett til to lag med molekyler nær overflater. Matrikspotensialet er ikke noen eget ledd i vannpotensialet, men inngår i trykkpotensialet (tensjon) og det osmotiske potensialet. Det er mange typer overflater i en celle, det er altså ingen enkel vannholdig løsning. I tillegg er cytoplasma en kolloidal løsning i et flytende løsningsmiddel, sol. Vannets dipolegenskaper gjør at den positive ladningen til vannmolekylene bindes til negativt ladete overflater og senker den frie entalpi til vannet. Lokalt nær overflatene får man også en oppkonsentrering av kationer.
Vannpotensial i luft
Vanndamp er en gass som har sitt eget partialtrykk (vanndamptrykk). Vanndamptrykket (e) øker med temperaturen. Når luften er mettet ved vanndamp ved en bestemt temperatur har vi vanndampmetningstrykk (e0). Vanninnholdet i luft kan måles som relativ fuktighet (RF) målt i %.
![]()
Vanndampinnholdet i lufta kan også angis som vanndamptrykkdeficit: e0-e
![]()
Det kjemiske potensialet til vanndamp i luft blir lik:
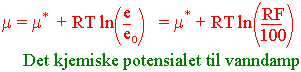
Vannpotensialet til vanndamp i luft blir lik:

Når luften er mettet med vanndamp ved en gitt temperatur dvs. relatif fuktighet = 100 % blir vannpotensialet for vanndamp i luft lik 0.
100
99
98
97
96
90
50
0
0
-1.36
-2.72
-4.11
-5.51
-14.2
-93.6
- uendelig
2.33
2.31
2.28
2.26
2.24
2.10
1.17
0
Tabellen viser at minskning i vannpotensial i luften etterhvert som den blir tørrere ikke gir seg tilsvarende utslag på vanndamppartialtrykket. Store høyder er nødvendig for at partialtrykket til vanndamp skal reduseres. ca. 1000 m gir 7 % reduksjon.
"Det er mer vann i agurk, enn det er vann i sjøvann"
Satt på spissen er det en snev av sannhet i dette hvis vanninnholdet i en agurk er 97 % og sjøvann inneholder 3.5 % salt. Det livet vi kjenner fra vår planet er helt avhengig av vann. Med unntak av tørre frø med vanninnhold 5-15 % er vanninnholdet i planter høyt, fra 35 - 95 % av friskvekten. Evolusjonsovergangen for plantene i vann til omgivelser med luft har krevet store tilpasninger. Levende organismer har oppstått i vann og evolusjonen har utnyttet egenskapene til vannet. Vann er et universalløsningsmiddel for plantene. For å kunne ta opp karbondioksid til bruk i fotosyntesen må plantene stå i kontakt med en stor mengde luft. Dette medfører et stort vanntap fra plantenes overjordiske overflater. På en varm dag kan alt vannet i et blad skiftes ut på en time. Vanntapet har en funksjon. I tillegg til den kjølende effekten når vann fordamper fra overflatene er plantene avhengig av næringssaltene som transporteres med vannet i vedvevet. 95 % av alt vannet planten tar opp går rett igjennom planten. En fullvoksen bjerk kan miste 70 liter vann om dagen og opptil 400 liter hvis det er svært varmt. Dette betyr at skogen gir en betydelig drenering av jorda. Vanligvis trenger plantene fra 400 - 1000 liter vann for å lage ett kilo tørrstoff. Det vil si at det trengs ca. 500 liter vann for å lage 1 kilo korn.
En vanlig sugepumpe som arbeider ved atmosfæretrykk kan ikke suge vann høyere enn 10.3 m. Hvis et langt tynt rør fylles med vann , tettes i den ene enden og settes på høykant ned i vann med den åpne enden vil vannet stå maksimalt 10.3 m, over dette vil det være vakuum. Ifølge Guiness Book of World Records er det høyeste treet i verden en Sequoia sempervivens (113.1 m høyt). Vannet i treet er bundet så hardt til celleveggene med vedhengskrefter (adhesjon) og sammenhengskreftene mellom vannmolekylene (kohesjon) gjør at det dannes en sammenhengende fase med vann fra rota til toppen av treet som kan bli over 100 m høyt. Vanntransporten fra rota opp i planter og trær skjer i vedvevet (xylem). Rotas vedvev står i direkte kontakt med vedvevet i stengel, stamme, greiner og blader. Det er sannsynlig at problemer med å få vann opp til toppen begrenser høyden av de høyeste trærne i verden. I norsk skog trenger ikke vannet å komme høyere enn 45 meter som en høyderekorden for et norsk grantre. I utgangspunktet blir ikke vannet fraktet opp i xylemcellene i ledningsvevet, fordi vanet er der allerede i utgangspunktet når cellene lages fra vekstlaget (det vaskulære kambiet) eller vekstpunktet (apikalt meristem). Måles diameteren på et tre vil man se at det har mindre diameter om dagen når treet har stort vanntap, enn om natten. Dette skyldes tensjonen i vannet i stammen. Veggfortykkelser i xylemet virker som styrkevev og gjør at cellene ikke klapper sammen på grunn tensjonen. At det skal kunne være tensjon i vannledningsvevet forutsetter at cellene er helt fylt med vann. Prinsippet er det samme som en sprøyte fylt med vann. Holder vi for spissen av sprøyte med vann og trekker i stempelet får vi forskjellige trykk på utsiden og innsiden av sprøyten. Slik har også vannet det i det døde ledningsvevet når plantene transpirerer. Bortsett fra at vann i plantecellene bindes hardere til veggene enn til veggen i sprøyten. Trykker vi stempelet inn og fremdeles holder for spissen, så har vannet i sprøyten et trykk.
Energien til å drive vanntransporten i plantene kommer opprinnelig fra sola. Tørr luft får vann til å fordampe fra bladene. Det skapes en tensjon i vannet i celleveggene i bladet som forplanter seg gjennom hele planten eller treet ned til vannet i jorda. Jo tørrere luften er desto større er transpirasjonen. Hvis en vannsøylene i en xylemcelle skulle briste stopper vanntransporten bare opp i dette røret. Jo større diameter vannledningselementene har jo større er muligheten for at vannsøylene skal briste. Vannmolekylene kleber seg også til celleveggene. Bindingen av vann til celleveggene gjør at vannet ikke forsvinner rett ut i lufta. Kommer det luft inn i rørene som frakter vann er det umulig å oppnå undertrykk siden en gass alltid gir positivt trykk. Luft kan komme ut av vannløsningen og danne gassbobler i vedrør og trakeider. Dette kan skje når vanntapet fra bladene er ekstremt høyt eller om vinteren forårsaket av frost. Med en spesiell mikrofon er det mulig å høre en rekke "klikk" fra f.eks. villvin når transpirasjonen er svært høy. "Klikkene" kommer muligens fra vannsøyler som brister på grunn av sterk transpirasjon. Luftbobler stopper bare transporten i xylemcellen hvor den dannes. Luftemboliene har ikke mulighet til å spre seg fra et rør til et annet. Det er mindre sannsynlig at det skal danne seg luftbobler i trakeidene med liten diameter enn i de større vedrørene. Trakeidene sørger derfor for den sikreste vanntransportveien selv om kapasiteten er mindre. Under vekstsesongen dannes det stadig nye vannfylte vedelementer som kan erstatte luftfylte ødelagte vedrør og trakeider. Vanntransporten kan også gå på tvers av stammen eller i en spiralform opp igjennom treet. Hastigheten for vanntransporten er i bartrær ca. 1 m per time. Hos løvtrær med ringporet ved er hastigheten 4-40 m per time og i arter med spredtporet ved 1-6 m per time. Betraktes fasen med vann fra vannet i jorda , gjennom planten og ut i lufta som et "vanntog" vil "lokomotivet" stå bakerst, det vil si ved vannet i jorda som har høyest vannpotensial. Høyest potensial gir størst evne til å utføre arbeid. For å gjøre det enklere kan man si at vann beveger seg fra høy konsentrasjon i jorda, gjennom planten til lav konsentrasjon utenfor planten.
Store vedrør gir nok vann til trekronen for bare ett år ad gangen og det må lages nye neste vår. Ved er et usedvanlig materiale. Vi kan bruke det til å bygge hus og båter og til å lage papir, møbler og musikkinstrumenter eller det kan brukes til vedfyring. Denne veden har trærne brukt til å frakte vann og næringssalter fra jorda opp i treet. I urteaktige planter skjer denne transporten i xylemet (vedvevet) i ledningsstrengene.