De tyske enzymologene Leonor Michaelis (1875-1949)og Maud Menten (1879-1960) postulerte i 1913 en teori for enzymkatalyserte reaksjoner. Ifølge Michaelis-Menten-hypotesen kan katalysereaksjonen for enzymer deles i to prosesser. Først danner enzymet (E) raskt et reversibelt kompleks med substratet (S) og danner et enzym-substratkompleks (ES), og som deretter spaltes og danner et produkt P og fritt enzym.
\(\displaystyle E + S \iff ES \iff E + P\)
Første del av enzymreaksjonen med binding mellom enzym og substrat har hastighetskonstantene for hver av de to retningene:
\(\displaystyle E + S\;\;\, \overrightarrow{k_1}\; ES\)
\(\displaystyle E + S\;\;\, \overleftarrow{k_{-1}}\; ES\)
Den kjemiske reaksjonen skjer i neste trinn hvor enzymsubstratkomplekset ES spaltes noe saktere i en reversibel reaksjon og danner produkt (P) og fritt enzym (E),med de to hastighetskonstantene
\(\displaystyle E S\;\;\,\; \overrightarrow{k_2}\; \;\; E + P\)
\(\displaystyle ES\;\;\, \;\overleftarrow{k_{-2}}\; \;E + P\)
I en enzymreaksjon er det flere hastighetskonstanter som kan være begrensende.
Hvis k2 er et hastighetsbegrensende trinn, det vil si hastighetskonstanten k-1 er mye mindre enn k2 så vil i dette tilfellet Km gi et mål på substrataffiniteten til enzymet, også kalt dissosiasjonskonstanten Kd:
\(\displaystyle K_m= \frac{k_{-1}}{k_1}=K_d\)
Det betyr at Km-verdien ikke alltid er et mål på substrataffiniteten til enzymet, det avhenger av forover og bakover hastighetskonstanter i delreaksjonene.
Man kan e.g. anta at enzymproduktkomplekset EP omdannes til produkt med en hastighetskonstant k3:
\(\displaystyle E P\;\;\,\; \overrightarrow{k_3}\; \;\; E + P\)
Det betyr at det meste av enzymet befinner seg i formen EP ved metning:
\(\displaystyle V_{max}= k_3 [E ]_0\)
Alle trinnene har sine hastighetskonstanter for reaksjonenes begge retninger. Den generelle hastighetskonstanten for denne 1. ordens reaksjon er kcat (den katalyttiske konstanten) som beskriver det hastighetsbegrensende ledd i enzymreaksjonen.
Sammenhengen mellom den initielle reaksjonshastigheten v (dannelse av produkt eller fjerning av substrat) og substratkonsentrasjonen S er gitt ved Michaelis-Menten- ligningen.
\(\displaystyle v= V_0= \frac{V_{max}[S]}{K_m + [S]}= \frac{[E]_0k_{cat}[S]}{K_m + [S]}\)
hvor [E]0 eller også benevnt [Et] er den totale enzymkonsentrasjonen, og den førsteordens hastighetskontanten kcat får måleenheten den resiproke av tid, oftest per sekund (s-1).

Michaelis-Menten plot for en enzymreaksjon som følger denne type kinetikk
Vmax er den maksimale reaksjonshastigheten for enzymet, og Km (Michaelis-konstanten) er substratkonsentrasjonen som gir halvparten av den maksimale reaksjonshastigheten. Man forutsetter at konsentrasjonen av enzym er liten i forhold til substratkonsentrasjonen(e). Vanligvis er reaksjonshastigheten proporsjonal med enzymkonsentrasjonen [E]0. Initialhastigheten (V0) i en enzymreaksjon måles før substratkonsentrasjonen har sunket nevneverdig og produktkonsentrasjonen er derved lav. Initialhastigheten finnes ved å trekke en tangent fra starten av kurven som fås ved å plotte reaksjonshastigheten som funksjon av tiden. I starten av reaksjonen er det lite produkt slik at man kan se bort fra den reverse hastighetskonstanten k-2, slik at:
\(\displaystyle V_0 = k_2 \left[ ES\right]\)
Enzymer som virker på substrater i cellen som finnes i lave konsentrasjoner har som oftest lave Km-verdier sammenlignet med enzymer som omsetter substrater som finnes i høye konsentrasjoner.
H. Lineweaver og D. Burk laget en lineær utgave av Michaelis- Menten-ligningen kalt Lineweaver-Burk ligningen eller et dobbelt-resiprokt plot. Den fremkommer ved å tarden resiproke av hver side av Michaelis-Menten-lingningen
\(\displaystyle V_0= \frac{V_{max}[S]}{K_m + [S]}\)
\(\displaystyle \frac{1}{V_0}= \frac{K_m + [S]}{V_{max}[S]}\)
Dertter kan man atskille i to delene av telleren på høyre side av ligningen:
\(\displaystyle \frac{1}{V_0}= \frac{K_m}{V_{max}[S]} + \frac{[S]}{V_{max}[S]}\)
Dette gir Lineweaver-Burk ligningen:
\(\displaystyle \frac{1}{V_0}= \frac{K_m}{V_{max}[S]}+ \frac{1}{V_{max}}\)
Dette er en rett linje av type y= ax + b, hvor a er stigningstallet og b er skjæring med y-aksen.
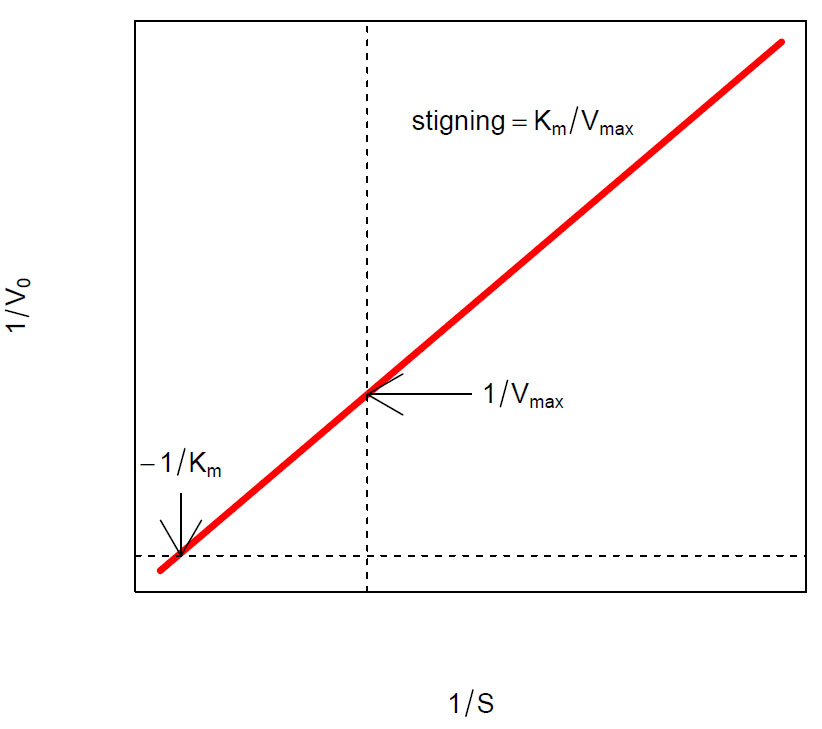
Lineweaver-Burk plot for en enzymreaksjon som følger Michaelis-Menten kinetikk. Måleenheten for 1/[S] på x-aksen kan e.g. være 1/mM, mens måleenheten på y-aksen 1/V0 kan være (1/(µM/min)).
Lages det en grafisk framstilling av 1/[S] på x-aksen mot 1/V0 på y-aksen får man en rett linje som skjærer y-aksen ved 1/Vmax og x-aksen ved -1/Km. Derved kan man bestemme de kinetiske konstantene Vmax og Km for enzymreaksjonen. Lineweaver-Burk- ligningen har en ulempe ved at dataene som har størst betydning for bestemmelse av de kinetiske konstantene tillegges minst vekt. For å unngå dette kan man lage et Eadie- Hofstee-plot hvor V0 på x-aksen plottes mot V0/[S] på y-aksen. Da får man en linje med stigningskoeffisient -Km og linjen skjærer X-aksen ved verdien for Vmax. I eksemplet ovenfor er det et enzym som bare reagerer med ett substrat. De fleste enzymer har imidlertid to substrater.
Kinetikken for allosteriske enzymer kan studeres ved et Hill-plot. Dixon-plot er en grafisk metode for å bestemme inhibitorkonstanten Ki ved kompetitiv eller nonkompetitiv hemming av enzymreaksjoner. Gjøres ved å plotte den inverse av reaksjonshastigheten mot inhibitor-konsentrasjone ved en konstant substratkonsentrasjon. Haldane relasjon er et utrykk som kobler likevektskonstantene til enzymreaksjoner med de kinetiske konstantene for forover- og reversreaksjonene.
Enzymaktivitet måles i katal. 1 katal (kat) er enzymaktiviteten som omdanner ett mol substrat per sekund.
D en katalyttiske hastighetskonstanten kcat til en enzymreaksjon, omsetningstallet, er lik Vmax/[E] hvor Vmax er maksimal reaksjonshastigheten og [E] er den molare konsentrasjonen av aktive seter på enzymet. Ved lave konsentrasjoner av substrat [S] i forhold til Km så blir:
\(\displaystyle V_ 0 = \frac {k_{cat} [E]_0[S]}{K_m + [S]} \implies V_0= \frac{k_{cat}}{K_m}[E]_0 [S]\)
Forholdet:
\(\displaystyle \frac{k_{cat}}{K_m}\)
kalles spesifisitetskonstanten. Tallverdien for Km (måleenhet molar M, vanligvis millimolar eller mikromolar) og kcat (måleenhet per sekund (s) er nyttige i sammenligning av den katalyttiske effektiviteten til enzymer. Superoksid dismutaser er noen av de mest effektive enzymene som finnes og katalyttisk effektivitet kcat/Km i størrelsessorden 10-9 M-1 s-1. , mens katalase og karbon anhydrase som også er meget effektive enzymer har et forhold i størrelsesorden 10-7 M-1 s-1.
Ofte katalyserer enzymer reaksjoner med to eller flere substrater. Subsstratene kan bindes samtidig til de aktive setene på enzymet eller i rekkefølge. Reaksjonen kan beskrives med Cleland nomenklatur, for eksempel på et enzym med to substrater som danner to produkter.
Enzymaktiviteten avhenger av pH og enzymer kan hemmes reversibelt eller irreversibelt ved å binde molekyler som hemmer (inhibitorer I) enzymreaksjonen. Tilbakekobling og hemming av enzymreaksjoner er vanlig i metabolsimen. Hemmingen kan være kompetitiv eller ikkekompetitiv. Kompetetiv og ikke-kompetitiv hemming gir forskjellig type dobbelt-resiproke plot.