Mineralnæring
Svovel
- Sulfatassimilasjon - svovel inn i organiske forbindelser
- Syntese av svovelaminosyren methionin
- Syntese av tripeptidet glutathion - et reservoir for redusert svovel
- Metallothioneniner og fytochelatiner - svovelproteiner og peptider som binder tungmetaller
- Thioredoksiner - aktivering og inaktivering av enzymer
- Dimetylsulfid fra hav
Svovel inngår i aminosyrene cystein og methionin. Disulfidbindinger i protein er viktige for den tredimensjonale strukturen til proteiner. Det katalyttiske sete i enzymet kan også inneholde svovel. Jern-svovelproteiner har en rekke funksjoner i plantene bl.a. elektrontransport. Ferredoksin er en viktig elektrontransportør i plantenes fotosyntese. Svovel finnes også i koenzymer (koenzym A) og i vitaminer (biotin (vitamin B6, thiamin (vitamin B1). Acetylgruppen til coenzym A (-CO-CH3 ) brukes i Krebs-syklus eller fettsyremetabolismen.
Tripeptidet glutathion som er et viktig svovelreservoir og deltar i redoksreaksjoner i cellene inneholder cystein. Svovel inngår i sekundærmetabolismen hos planter ved dannelse av glukosinolater (sennepsoljeglykosider). Glukosinolatene lagres i vakuolen og hydrolysen skjer ved myrosinase som finnes i noen få celler i blad og frø. Ikkeprotein svovelaminosyren alliin (S-allyl- cystein sulfoksid) i hvitløk spaktes av enzymet alliinase når plantevevet skades. Brokkoli inneholder sulforafan. Det finnes mange eksempler på ikkeprotein svovelaminosyrer i planter f.eks. metylmethionin, djenkolsyre (djenkolbønner Pithecolobium lobatum, S-metylcystein, S- propylcysteinsulfoksid og S-metylcystein sulfoksid). Sulfolipider inneholder svovel i oksidert form. S-adenosylmethionin inngår som metyldonor i metyleringsreaksjoner. Svovelforbindelser gir en karakteristisk lukt fra bl.a. kål og løk.
Svovel tas opp av røttene vesentlig i form av sulfat (SO42-). Sulfat kan reduseres i røttene eller bli transportert via xylemet til bladet hvor også reduksjonen skjer. Transporten over plasmamembranen er en SO42-/H+ symport. Plantene kan til en viss grad ta opp svoveldioksid (SO2) gjennom bladene og bruke det som svovelkilde. Forøvrig er høye konsentrasjoner av SO2 giftig for plantene. Svoveldioksid danner bisulfitt (HSO3-) i reaksjon med vann og bisulfitt kan hemme fotosyntese.
Sulfat kan inkorporeres i sulfolipider uten reduksjon, men forøvrig må sulfat reduseres før det kan assimileres inn i organiske forbindelser. Sulfolipider finnes i thylakoidmembraner.
Svovelmangel gir jevnt blekgule planter (klorose). Svovel kan til en viss grad retranslokeres via floemet.
Under anaerobe forhold kan sulfat brukes som elektronakseptor av mikroorganismer og bli omdannet til giftig hydrogensulfid (H2S)
Olje inneholder svovel og ved forbrenning dannes svoveldioksid (SO2). Svoveldioksid blir oksidert i atmosfæren til sulfat og er sammen med nitrat dannet fra oksidering av nitrogenoksider en viktig faktor i "sur nedbør".
Sulfatassimilasjon - svovel inn i organiske forbindelser
Svovel må reduseres før det kan inngå i organiske forbindelser og i sulfatreduksjon trengs det 8 elektroner:
![]()
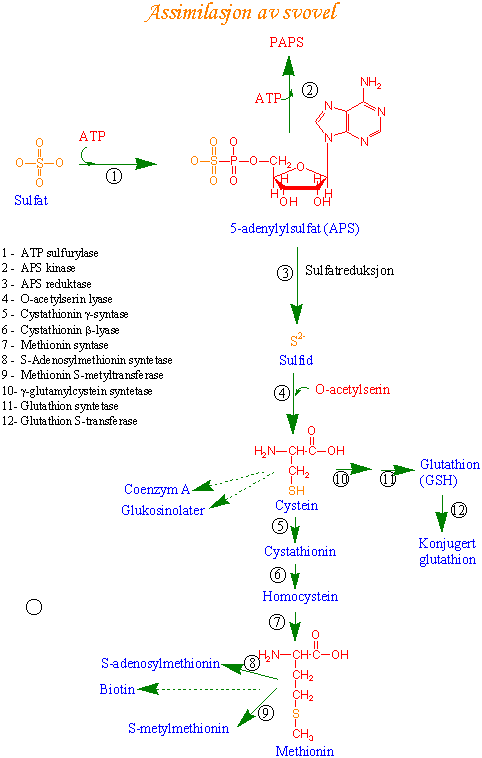
Sulfatreduksjonen er størst i bladene og reguleres både via enzymaktiviteter og transkripsjonsnivå. Første trinnet i sulfatassimilasjonen er aktivering av sulfat (SO42-) med ATP, katalysert av ATP sulfurylase som erstatter to av fosfatgruppene på ATP med sulfat og gir adenosin-5-fosfosulfat (APS) og pyrofosfat (PPi).

Enzymet som finnes både i cytosol og plastider påvirkes både av lys og reduserte svovelforbindelser f.eks. cystein og redusert glutathion (GSH). APS kan være substrat for syntese av enten 1) sulfatestere eller 2) inngå i sulfatreduksjon. For syntese av sulfatestere vil enzymet APS kinase fosforylere APS og lage fosfoadeninfosfosulfat (PAPS) i en ATP-avhengig reaksjon katalysert av APS kinase. Fra PAPS overføres aktivert sulfat til en hydroksylgruppe og gir en sulfatester.
Hos planter og alger er APS sulfatdonor i reduksjonen katalysert av APS sulfotransferase, et viktig reguleringsenzym i sulfatreduksjonen. Dette enzymet er også kalt APS reduktase. Sulfat overføres fra APS sulfotransferase til en thiolforbindelse som virker som bærer og det dannes et thiosulfonat. Hvis redusert glutathion (GSH) er bærer vil det dannes S-sulfoglutathion. Overføringen av sulfat til en thiolgruppe gir samtidig reduksjon av sulfat til sulfitt (SO32-). Den påfølgende reduksjon av bærerbundet sulfitt til sulfid S2- skjer via enzymet sulfitt reduktase eller organisk thiosulfat reduktase. Sulfitt reduktase katalyserer reaksjonen:

Redusert ferredoksin er elektrondonor. Siste trinn i sulfatreduksjonen er at sulfidgruppen (S2-) overføres til O-acetylserin. O-acetylserin lages fra serin og acetyl-CoA katalysert av serin acetyltransferase. O-acetylserin får overført sulfid, og spaltes til acetat og aminosyren cystein, som er det første stabile produkt i sulfatreduksjonen. Trinnet er katalysert av cystein syntase (O- acetylserin thiollyase).
![]()
Svovelgruppen i cystein kalles thiol og virker som elektrondonor (nukleofil).
Syntese av svovelaminosyren methionin
Methionin er en av de nødvendige eller essensielle aminosyrene i ernæringen hos dyr og mennesker. Aminosyren methionin lages fra cystein. Først reagerer cystein med O-fosfohomoserin katalysert av cystathionin g-syntase og produktet er cystathionin. Deretter spaltes cystathionin av enzymet cystathionin-b-lyase til homocystein, pyruvat og ammonium. En metylgruppe overføres til homocystein katalysert av methionin syntase. Metylgruppen kommer fra S- metyltetrahydropteroyltriglutamat.
Syntese av methionin (aspartatfamilien av aminosyrer)
Syntese av tripeptidet glutathion - et reservoir for redusert svovel
Syntesen av tripeptidet glutathion (glutamat-cystein-glycin) skjer i to trinn. Først lages glutamylcystein katalysert av g-glutamylcystein syntetase og glycin kobles til i neste trinn katalysert av glutathion synthase, et enzym som trenger magnesium. Det er mye glutathion i kloroplasten, opptil mM konsentrasjoner. Glutathion har en viktig funksjon sammen med askorbat i kloroplasten (askorbat-glutathion syklus). Glutathion er også et viktig lager for redusert svovel og er forkomponent for fytochelatiner. Glutathion i redusert form skrives som GSH og som oksidert disulfid GSSG.
Glutathion binder seg til elektrofile stoffer som ugrasmidler og xenobiotika katalysert av enzymet glutahion S-transferase.
Metallothioneniner og fytochelatiner - svovelproteiner og peptider som binder tungmetaller
Metallothioneniner er svovelrike proteiner med mye cystein og som kan binde tungmetaller. Fytochelatiner er peptider som kan binde tungmetaller og er dannet av aminosyrene cystein, glutamat og glycin (g-glutamat-cystein)n-glycin, n=2-11). Syntesen av fytochelatiner som lagres i vakuolen induseres av tungmetaller.
Thioredoksiner - aktivering og inaktivering av enzymer
Thioredoksiner er en gruppe lavmolekylære proteiner som inneholder to cystein som danner en redoksaktiv intermolkylære disulfidbro. Thioredoksin kan reversibelt enten oksideres eller reduseres. Redusert thioredoksin aktiverer fruktose-1,6-bisfosfatase og flere enzymer i Calvinsyklus. Både redusert ferredoksin og NADPH benyttes i reduksjon av thioredoksin.
Dimetylsulfid fra hav
Alger kan lage dimetylsulfonpropionsyre som når det skilles ut i havvannet kan omdannes til dimetylsulfid som er flyktig og deltar i dannelsen av skyer.
Litteratur:
Leustek, T. & Saito, K.: Sulfate transport and assimilation in plants. Plant Physiol. 120 (1999) 637- 643.