Hydrogensulfid og pH
Hydrogensulfid er flyktig, men løser seg i vann. Det innstiller seg en likevekt mellom gassfase og væskefase, og en pH-avhengig likevekt mellom dihydrogensulfid (H2S) og de to anionene hydrogensulfid-ion (HS-) og sulfid-ion (S2-).
H2S(g) ↔H2S(aq) ↔HS- + H+↔ S2- + 2H+
H2S er en svak syre, I et åpent system vil likevekten forskyve seg mot venstre ifølge Le Chateliers prinsipp hvor H2S går over i gassfase. I rent vann foreligger mesteparten som HS- og S2- ifølge Bjerrum-diagram. Tilsettes syre til vann flyttes likevekten mot venstre og overskrides løselighetsverdien avgis H2S til luften. H2S er en svak syre (pKa1= 7.05) i likevekt med anionene HS- og S2-. Hydrogensulfidionet (HS-) er en meget svak syre (pKa2= 12.9), men pKa-verdiene variere under forskjellige betingelser (temperatur, saltinnhold).
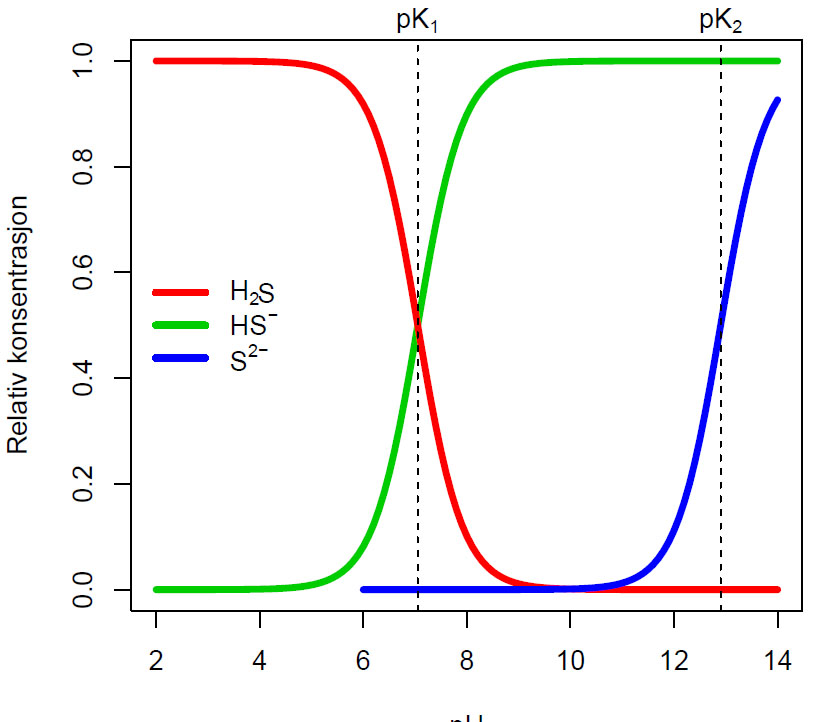
Bjerrumdiagram for hydrogensulfid (H2S). I sur løsning pH <4 forligger omtrent alt som H2S. Med økende pH skifter likevekten mot HS- og S2-. Ved fysiologiske betingelser er omtrent 80% av H2S i form av monoanionet HS-.
H2S og metabolsk funksjon
H2S er lipofil og kan diffundere gjennom biomembraner. Dissimilatorisk sulfatredusjon hos sulfatreduserende bakterier produserer hydrogensulfid.
SO42- → H2S
Ved assimilatorisk sulfatreduksjon i planter og bakterier blir sulfat redusert til sulfid før det blir inkorporert i svovelaminosyrene cystein og metionin.
Ved nedbrytning av organisk materiale kan det ved desulfurylering bli dannet hydrogensulfid:
Organisk-SH → H2S
Anaerobe fotosyntetiske bakterier kan bruke hydrogensulfid som elektron- og protonkilde:
6CO2 + 12 H2S → C6H12O6 + 12S + 6H2O
Den nederlandske mikrobiologen CB van Neil kunne I 1931 med bruk av purpursvovelbakterier og grønne svovelbakterier vise at fotosyntesen er en lysavhengig redoksprosess hvor elektroner og protoner fra hydrogensulfid kan bli brukt til å redusere CO2 til organisk materiale. Van Neil oppdaget at det at inne i bakteriene ble det dannet korn med svovel (S), oksidasjon av H2S til S0.
Fra dette kunne man slutte at vann (H2O) er elektron- og protondonor i fotosyntese hos grønne planter hvor vann blir oksidert il oksygen.
Hydrogensulfid (H2S) har en nødvendig metabolsk funksjon i lave konsentrasjoner bl.a. i i nervesystemet, men er giftig i høye konsentrasjon. Hydrogensulfid virker som et reduksjonsmiddel i redoksbiologi, blir selv oksidert og avgir elektroner og protoner og det vanligste oksidasjonsproduktet er svovel (S). H2S deltar i post-translasjonmodifisering av cystein i proteiner og danner persulfider (RSSH) via S-persulfidering eller disulfider (RSSR), samt kan inngå i reaksjon med oksidanter, metaller og tioler (RSH).Feil i regulering av konsentrasjonen av hydrogensulfid i organismen kan gi flere typer sykdomstilstander.
H2S kan i pattedyr delta i signaloverføring i gassform i celler slik som nitrogenmonoksid (NO) og karbonmonoksid (CO). Analogt til nitrosylering av proteiner med NO er sulfhydrering av reaktivt cystein i proteiner med H2S.
Hos planter deltar H2S i persulfidering posttranslasjonsregulering av proteiner
H2S kan redusere oksidativt stress. H2S blir laget endogent av enzymet cystationin gamma (γ)-lyase med pyridoksalfosfat som kofaktor omdanner cystationin til svovelaminosyren cystein og 2-oksobutyrat.
cystationin + H2O↔ cystein + 2-oksobutyrat
Enzymet kan i tillegg hos noen bakterier og pattedyr produsere pyruvat, ammoniakk og hydrogensulfid fra aminosyren cystein. Enzymer som kan danne H2S er cystationin-β-syntase ,cystationin-γ-lyase ,og 3-merkaptopyruvat svoveltransferase.
Forgiftninger fra H2S
H2S fra gjødselkjellere kan forgifte husdyr i fjøset. På havbunnen under oppdrettsanlegg kan det samle seg rester fiskefôr, avføring og detritus som gir organiske materiale som blir anaerobt omsatt av sulfatreduserende bakterier som kan danne H2S som bobler opp og forgifter oppdrettsfisk i merdene.
500 ppm H2S kan være dødelig. Yrkesmessig grenseverdi 5 ppm (7 mg m-3), korttidseksponering 10 ppm (14 mg m-3). Luktterskel ca. 0.13 ppm. Hydrogensulfid kan reagere med jernproteinet cytokrom c oksidase i mitokondriene noe som man antar er virkningsmekanismen for giftigheten av hydrogensulfid med blokkering av respirasjonskjeden. I tillegg kan hydrogensulfid reagere med transisjonsmetaller i proteiner og danne sulfider.
H2S og kjemi
Selv om molekylvekten til hydrogensulfid (H2S) er høyere er den mer flyktig enn vann (H2O) grunnet hydrogenbindingene i vann. HS-bindingen er svakere enn HO-bindingen i vann og H2S og HS- har derfor høyere syrestyrke enn H2O og hydroksylionet (OH-).
Hydrogensulfid er giftig og brennbar i høye konsentrasjoner. Kondensert til væske har den kokepunkt – 60.7oC. Hydrogensulfid løser seg lett i vann ca. 122 millimolar (mM)= 0.122 M ved 2ooC, ca. 80 mM ved 37oC.
Klassisk fremstilling av hyhdrogensulfid i laboratoriet er en reaksjon mellom jernsulfid (FeS) og saltsyre (HCl):
FeS + 2HCl → H2S + Fe2+ + 2Cl-
Blir bl.a. brukt til utfelling av metallsulfider i laboratoriesammenheng. Sulfider av alkalimetaller er lett løselige, mens sulfider jordalkalimetaller er middels løselige. Tyngst løselig er metallsulfider som jernsulfid, kobbersulfid, og kvikksølvsulfid.
Hydrogensulfid kan bli absorbert i en svak basisk løsning med organiske baser og avgitt ved oppvarming. Hydrogensulfid blir brukt i produksjon av svovel (S) og svovelsyre etter forbrenning til svoveldioksid (SO2). Molekylvekt H2S er34.09.
Hydrogensulfid kan reagere med oksidantene superoksid anion O2ꞏ- og hydrogenperoksid (H2O2). Reaksjon mellom H2S og ꞏNO kan gi ONOOH /ONOO-. Autooksidasjon av H2S med oksygen (O2) danner sulfitt, tiolsulfat og sulfat. Disproporsjonering av tiosulfat (S2O32-)
S2O32- → H2S + SO42-
Metoder for deteksjon av H2S med fluorescensmetoder baserer seg på at H2S eller HS- reduserer aromatiske azider e.g. arylazider og nitrogrupper til aminer.
Svovel og redoksreaksjoner
Svovel kan finnes i forskjellige oksidasjonsnivåer:
Hydrogensulfid (H2S): -2
Grunnstoff og elementært svovel (S8): 0
Svovelmonoksid (SO): +2
Svoveldioksid (SO2): +4
Sulfitt (SO32-): +4
Sulfat (SO42-) : +6
Ved laveste oksidasjonstrinn (H2S) kan svovel bare bli oksidert.
Svovel kan reagere med metaller og danne sulfider, inngå i redoksreaksjoner med elektronoverføring eller danne ligander i koordinerte komplekser.
Hydrogensulfid reduserer giftigheten til metylkvikksølv (MeHg+) som omdannes til mindre giftig (MeHg)2S.
Litteratur
Li Q & Lancaster JR Jr.: Chemical foundations of hydrogen sulfide biology. Nitric Oxide 35(2013)21-34, doi: 10.1016/j.niox.2013.07.001