Oksidativt stress
- Oksygen og planter
- Oksygenmolekylet
- Triplett og singlett oksygen
- Fotosensitisering og fotodynamiske effekter
- Karotenoider beskytter planten
- Sekundære stoffskifteprodukter og fotodynamiske effekter
- Oksygenradikaler
- Antioksidantforsvar - enzymer og metabolitter
- Lipoksygenase og peroksidering av fettsyrer
- Luftforurensninger, radikaler og planter
Oksygen og planter
Oksygen (dioksygen) er et biprodukt ved spalting av vann i fotosyntesen. En ny æra i jordas utvikling startet med de fotosyntetiserende blågrønnbakteriene. Disse bruker vann som elektronkilde for å redusere luftas karbondioksid til sukker. Under evolusjonen tok landplantene også i bruk fikk den samme form for fotosyntese og oksygenkonsentrasjonen i atmosfæren steg til de 21 % vi har idag.
Oksygen fra fotosyntesen danner grunnlaget for utviklingen av de fleste artene som lever på jorda. Oksygen, det 8. element i det periodiske system, deltar i respirasjonen (celleåndingen) ved å motta elektroner. Oksidasjon av organiske substrater med oksygen som elektronakseptor frigir energien som er lagret i substratet og endeproduktene er karbondioksid og vann. Ringen er sluttet. Samtidig er oksygen en konstant trussel mot alt aerobt liv, og organismene har en rekke beskyttelsessystemer for å ta hånd om skadelige former av oksygen. Det er en hårfin balanse mellom oksygenforgiftning og det at det meste av livet vi kjenner er avhengig av oksygen, unntatt organismer som lever anaerobt. Som et biresultat av en oksygenatmosfære får organismene også vanskeligheter med å skaffe seg jern.
Oksygenmolekylet
Oksygen (dioksygen) er satt sammen av to oksygenatomer. Vi tar i bruk modeller for å kunne forestille oss hvordan oksygenatomene ser ut. En slik modell er elektronskallmodellen. Elektronene er ordnet i skall rundt kjernen av oksygenatomet. Et indre K-skallet hvor det er plass til 2 elektroner og et ytre L-skall hvor det er plass til 6 elektroner. Vi kan ta i bruk en modell til, elektronskymodellen, som viser at elektronene svever som skyer rundt atomkjernen. Formen på elektronskyene avhenger av hvilket orbital vi ser studerer. Ifølge Erwin Schrödinger kan vi bare snakke om sannsynligheten for å treffe på et elektron rundt atomkjernen. Fordelingen av disse sannsynlighetene kalles orbitaler. Eller sagt på en annet vis. På samme måte som lys kan elektronene betraktes både som partikler og bølger. Orbitalene er bølgefunksjonen for elektronene og sier noe om i hvilken energitilstand elektronene befinner seg. Shrödingerligningene beskriver sannsynligheten for å treffe på et elektron rundt kjernen på et bestemt sted.
K-skallet inneholder et orbital kalt 1s. I hver orbital er det bare plass til 2 elektroner, og disse spinner hver sin vei (Paulis eksklusjonsprinsipp). Vi forestiller oss at elektronet spinner rundt aksen på samme måten som vår planet eller som en snurrebass som kan rotere den ene eller andre veien. Energien har alltid diskrete verdier. Heisenbergs usikkerhetsrelasjon gjelder bare i atomære skala, og sier at vi ikke kan bestemme både posisjonen og spin til et elektron samtidig. Jo mer presist den ene av dem bestemmes, desto mer upresis blir bestemmelsen av den andre. Årsaken henger bl.a. sammen med bølge/partikkeldualiteten til lys og elektroner.
Av de 6 elektronene i L-skallet befinner 2 stykker seg i 2s orbital og de 4 siste i tre 2p orbitaler. To av 2p orbitalene har bare ett elektron, men disse har til gjengjeld parallelle spinn. Ifølge Hunds regel har elektroner med parallelle spinn lavere energi enn tilsvarende par med motsatt spinn. Spinnene gir små magnetfelter. Når 2p orbitaler i atomært oksygen hybridiseres får p*s* orbitalet lavere energi enn .
Triplett og singlett oksygen
Elektronene lager skyer rundt molekylene på samme måte som rundt atomene. Blandes de 5 atomorbitalene for hvert oksygenatom gir dette 10 molekylorbitaler med ialt 16 elektroner. Molekylorbitalet med lavest energi er s(sigma) orbitalet som tilsvarer s-orbitalet i atomet. p (pi) orbitalet i molekylet tilsvarer p-orbitalet i atomet. Orbitalene fra hvert oksygenatom ordnes i molekylorbitaler som vist på figuren.
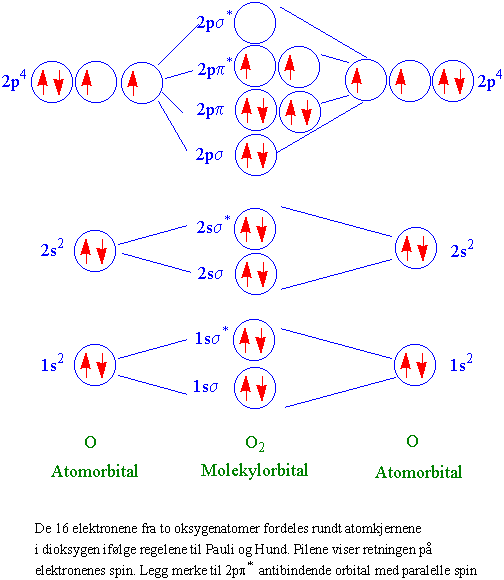
Orbitalene kan deles i bindende og antibindende orbitaler. Elektronene i de antibindende orbitalene, merket med * , har høyere energi enn de bindende orbitalene.
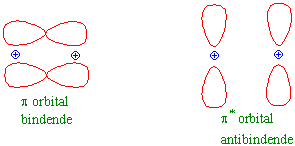
To motsatt spin gir magnetfelt lik 0. Siden oksygenmolekylet har elektroner i 2pp* orbitalet med parallelle spin får oksygenmolekylet et magnetfelt enten +1 eller -1. Dette utrykkes i det totale spin S= + 1. Det vil si at oksygenmolekylet ikke er megnetisk nøytralt, men paramagnetisk. Flytende oksygen vil kunne tiltrekkes av en magnet.
Multiplisiteten M angir antall mulige orienteringer av det totale spinn:

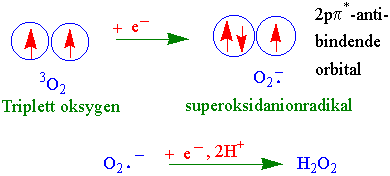
I grunntilstanden av molekylært oksygen blir M=3, det vil si et triplettstadium. Dette er triplett oksygen (3O, IIIO). Oksygenmolekylet kan motta energi og gå over i et singlett- stadium hvor spinnene i 2pp* orbitalet blir antiparallelle. Dette gir S=0 og M=1.
Singlett oksygen (1O2, IO) strider altså mot Hunds regel og oppstår når oksygenmolekylet tilføres energi.
Fotosensitisering og fotodynamiske effekter
Fargestoffer (klorofyll, riboflavin, hypericin, psoralener, curcumin, a-terthienyl, metylenblått, eosin etc.) kan fange opp lys og overføre lysenergien til oksygen i grunntil standen, som derved omdannes til singlett oksygen. Denne prosessen kalles fotosensitisering. Singlett oksygen er skadelig for alle levende organismer. De skadelige effektene av lys sammen med oksygen og et fargestoff kalles fotodynamiske effekter.
Det er bare elektroner med motsatt spinn som kan kobles og lage elektronparbinding. De fleste molekylene har elektronene i par med motsatte spinn. Disse reagerer tregere med oksygen i grunn tilstanden som har parallelle spinn i 2pp* orbitalet. Derfor er triplett oksygen et lite reaktivt molekyl sammenlignet med singlett oksygen. Det norske firmaet PhotoCure baserer seg på dette prinsippet hvor lys sammen med et pigment produserer singlett oksygen som brukes til å drepe kreftceller.
Karotenoider beskytter planten
Plantenes kloroplaster er et ideelt sted for å lage singlett oksygen. Klorofyll fanger opp energien i lyspartiklene og eksiteres til første singlett klorofyll (rødt lys) eller til andre singlett klorofyll (blått lys). Singlett klorofyll har kort levetid. Hvis spinnet for et elektron i klorofyllmolekylet snus kan det lages et triplett-stadium av klorofyll som har lang levetid (10- 3 sekunder). Dette er lang nok tid til at lysenergien kan overføres fra klorofyll til oksygen slik at det blir laget singlett oksygen.

Levetiden for singlett oksygen i vann er ca. 4 msekunder, men i upolare løsningsmidler er levetiden opptil 100 msekunder. Det vil si at inne i membraner har singlett oksygen lang nok levetid til å reagere med proteiner og umettede fettsyrer. Umettede fettsyrer peroksideres og aminosyrene histidin, metionin og tryptofan oksideres av singlett oksygen. Av nukleinsyrene er guanin spesielt følsom for singlett oksygen.
Det er laget en rekke ugrasmidler som blokkerer plantenes evne til å lage karotenoider ( f.eks. metflurazon, norflurazon, fluridon). Når plantene utsettes for lys etter å ha blitt behandlet med slike ugrasmidler har de ikke lenger mulighet til å beskytte seg mot skadelige former av oksygen, og dør.
Singlett oksygen kan omdannes til triplett oksygen ved at det sendes ut elektromagnetisk stråling med bølgelengd 1270 nm.
Sekundære stoffskifteprodukter og fotodynamiske effekter
Plantene inneholder en rekke sekundære stoffskifteprodukter. Disse beskytter plantene mot ugrasetere, insekter, sopp eller andre konkurrerende planter. Noen av disse stoffene har virkningsmekanismer som gir fotodynamisk dannelse av singlett oksygen. Arter av perikum f.eks. prikkperikum (Hypericum perforatum) inneholder hypericin som gir opphav til den blodrøde fargen på et etanolektrakt fra blomstene til prikkperikum. Når den som har fått i seg hypericin utsettes for lys starter omdanningen av oksygen til singlett oksygen. Derfor: vær forsiktig med perikumbrennevin. Dyr på beite som har spist planter med fotosensitiserende stoffer kan få sår i huden når de utsettes for sollys. Sauesykdommen alveld gjør dyrene følsomme for lys og de søker inn i skyggen. Fotosensitiserende stoffer i planten rome (Narthecium ossifragum) tror man er involvert i sykdommen, men soppendofytter i plantene som produserer slike stoffer er en annen mulighet. Psoralener (lineære furanocoumariner) fra skjermplanter er kjent for å danne kryssbindinger med DNA når de belyses med 320-420 nm lys. En prosess som går uavhengig av oksygen. I tillegg kan psoralener gi fotodynamisk produsert singlett oksygen. Det samme gjør a-terthienyl fra fløyelsesblomst (Tagetes) og polyacetylener. Humus i sjøer kan også gi opphav til singlett oksygen. Lysets betydning for giftvirkningen av mange plantestoffer er lite undersøkt.
Oksygenradikaler
I d-blokken i det periodiske system er det mange grunnstoffer som har en viktig funksjon i transporten av elektroner i planten: kobber (Cu), jern (Fe), mangan (Mn), zink (Zn), nikkel (Ni), og molybden (Mo).
Hvordan elektronene er fylt opp i 3d og 4s orbitalene for jern og kobber kan vi se på figuren.

Ved en-elektronoverføring som skjer via transisjonsmetallene er det alltid mulighet for å få laget radikaler. Transisjonsmetaller slik som jern kan lage koordinasjoner med mange ligander. Når jern er koordinert i en oktaeder-geometri slik som i hem, vil ikke de fem d- orbitalene ha samme energi. Splittingen av d-orbitalene vil gi tre d-orbitaler med lav energi og 2 d orbitaler med høy energi. De to energirike d-orbitalene blir vanskeligere å fylle med elektroner. Forskjellen i energi mellom lavenenergi og høyenergi 3d orbitaler i jern vil avhenge av hva slags ligander som bindes. Sterkt elektronegative ligander som oksygen gir stor energiforskjell, mens svake elektronegative ligander som vann gir liten energiforskjell. Radikaler kan i tillegg til enelektronoverføring via transisjonsmetallene (respirasjon, fotosyntese, cytokrom P450 ) også lages ved:
- 1) Enzymaktivitet f.eks. xanthin oksidase .
- 2) Homolyttisk spalting av kovalent binding.
- 3) Radioaktiv stråling.
- 4) Fenton-reaksjon.
- 5) Pseudosyklisk elektrontransport i kloroplastene.
- 6) Ved høy temperatur.
- 7) Ultralyd.
Oksygenradikaler kan lages på den indre mitokondriemembranen ved direkte oksidering av semiubikinon radikal av oksygen, det lages superoksidanioner og mengden øker jo mer ubiqinon som er redusert.
Når oksygen tar opp et ekstra elektron lages superoksidanionradikalet av oksygen. Mottas ett elektron til og to protoner fås hydrogenperoksid.
Reaktive svovelforbindelser
Reaktive svovelforbindelser som f.eks. RS×, RSOO×, RSO× dannet fra thioler, kan på lignende måte som reaktive oksygenforbindelser gi skader på DNA, protein og fettsyrer. Det finnes thiolspesifikke antioksidantenzymer som har en reduserende funksjon i cellen.
Antioksidantforsvar - enzymer og metabolitter
Superoksidanionradikalet og hydrogenperoksid tas effektivt hånd om av en rekke enzymer, henholdsvis superoksid dismutaser eller peroksidaser og katalaser. Superoksid dismutaser (SOD) er noen av de mest effektive enzymene vi kjenner. SOD dismuterer superoksidanionradikaler og det lages hydrogenperoksid. Det finnes flere forskjellige SOD: Cu/ZnSOD (cytosol og kloroplaster, MnSOD (mitokondrier) og FeSOD i kloroplasten hos noen arter.
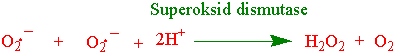
Katalase omdanner hydrogenperoksid til oksygen og vann. Katalase deltar i avgiftning av hydrogenperoksid som lages av SOD, under fotorespirasjonen, b-oksidasjon av fettsyrer og ved forskjellige typer stress. Katalase inneholder hem og finnes i peroksisomer og glyoksysomer.

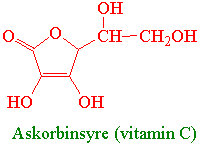
En rekke stoffer i planten som beskytter mot singlett oksygen gir også beskyttelse mot superoksidanionradikalet. Dette gjelder askorbinsyre (vitamin C) som er vannløselig, fettløselig a-tokoferol Planter i korsblomstfamilien inneholder i tillegg dithiothiol og indol-3-karbonol som også beskytter mot oksygenradikaler. (vitamin E), karotenoider og redusert glutathion. Flavonoider bl.a. anthocyaniner kan også ta hånd om fri radikaler. Ubikinon i redusert form kan virke som en antioksidant. Urinsyre har også antioksidantegenskaper.
Peroksidase er hemproteiner som oksiderer mange substrater ved bruk av hydrogenperoksid eller organiske hydroperoksider. De finnes i alle deler av plantecellen og katalyserer reaksjonen:

Askorbat peroksidase er eksempel på en slik peroksidase. Askorbat peroksidase er et hemprotein som oksiderer askorbat til askorbylradikal med hydrogenperoksid som oksidant. Konsentrasjonen av askorbat i kloroplasten er ca. 20-30 mM. Når askorbat brukes som elektrondonor omdannes det til askorbylradikal. Askorbat peroksidase bruker askorbat som elektrondonor ved reduksjon av hydrogenperoksid. I apoplasten regenereres askorbylradikalet til askorbat katalysert av NADH-askorbatradikal reduktase.
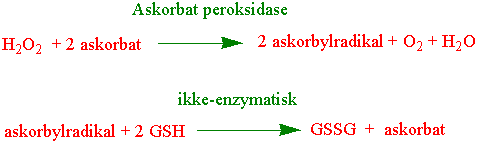
Monodehydroaskorbatradikalet omsettes videre av enzymet monodehydroaskorbat reduktase med NAD(P)H som elektrondonor. Det er også mulighet for at to monodehydroaskorbatradikaler kan reagere med hverandre slik at man får askorbat og dehydroaskorbat som produkt. Dehydroaskorbat kan deretter ved hjelp av glutathion omdannes til askorbat katalysert av enzymet dehydroaskorbat reduktase:
I planter finnes også cystein peroksiredoksiner som reduserer alkylhydroperoksider til alkoholer eller hydrogenperoksid kan reduseres til vann ved at det skjer en intramolekylær thiol/disulfidoverføring i enzymet. Dette er peroksidaser som ikke har hem. Det kan være både ett eller to cysteinmolekyler som inngår i reaksjonen. Finnes i kloroplaster og peroksysomer.
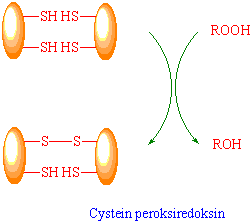
Tripeptidet glutathion er hovedformen av løselig thiol i planten. Glutathion har også lagringsfunksjon for svovel. Glutathion sammen med askorbat fjerner effektivt hydrogenperoksid via askorbat-glutathion syklus. Glutathion kan også brukes av planten til å avgifte f.eks. ugrasmidler ved konjugering katalysert av glutathion-S-transferase.
Glutathion reduktase regenerer redusert glutathion (GSH) fra den oksiderte formen (GSSG) ved hjelp av NAD(P)H:
![]()
a-tokoferol (vitamin E) er fettløselig og finnes i spesielt høye konsentrasjoner i thylakoidmembranene i kloroplastene. a-tokoferol kan:
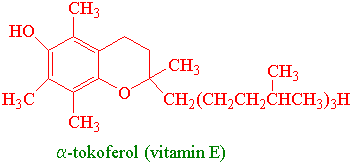
- 1) Avgifte singlett oksygen og hydroksylradikaler. Oksidasjonsproduktene er tokoferyl kinon og kinon epoksid.
- 2) Quenche singlett oksygen ved resonansenergioverføring. Ett molekyl a-tokoferol kan avgifte opptil 120 singlettoksygenmolekyler før det selv blir oksidert.
- 3) Hindre fettsyreperoksidering ved å bryte kjedereaksjonen. Vitamin E reduserer fettradikaler og blir selv oksidert til a-chromanoksylradikal. a-tokoferol regenereres ved hjelp av askorbat og glutathion.
Antioksidantforsvaret hos planter er helt vitalt for å sikre overlevelse i en oksygenatmosfære. Karotenoidene spiller en viktig rolle i oksidantforsvaret og antioksidanteffekten til karotenoidene er forskjellig fra quenchingen av singlett oksygen.
Andre eksempler påantioksidanter fra planteriket:
Vitaminer (vitamin C, vitamin E)
Flavonoider: Anthocyaniner (cyanidin, delphinidin, oenin). Flavon-3-oler (quercetin, kaempferol). Flavoner (rutin, apigenin, chrysin, luteolin). Flavan-3-oler (epicatechin, fra te: epigallocatechiner, epicatechin gallat, epigallocatechin gallat). Flavanoner (naringenin, herperidin, hesperetin, taxifolin, narirutin). Hydroksycinnamater (kaffeinsyre, klorogensyre, ferulinsyre p-coumarat). Theaflaviner fra te : (theaflavin, theaflavin-3-gallat, theaflavin digallat).
Thioler (redusert glutathion, cystein, methionin)
Karotenoidene kan også inngå i følgende reaksjoner:
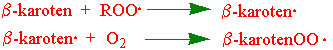
Både b-karoten· og b-karotenOO· er inaktive produkter.
VAZ syklus
Xanthofyllsyklus (VAZ syklus) i kloroplasten er koblet sammen med fotosyntesen og fjerner overskudd av eksitasjonsenergi. Syklusen bruker karotenoidene violaxanthin, antheraxanthin og zeaxanthin. Er det mye lys omdannes violaxanthin til zeaxanthin. Er det lite lys omdannes antheraxanthin og zeaxanthin til violaxanthin. Lysblad inneholder mer av karotenoidene violaxanthin, antheraxanthin og zeaxanthin enn skyggeblad. Epoksideringen med pH optimum ca. 7 bruker NADPH fra stroma og de-epoksideringen med pH optimum ca. 5 på lumensiden av membranen bruker askorbat. Systemet brukes til å regulere reduktantnivået i kloroplasten. Når det er et overskudd av eksitasjonsenergi vil violaxanthin bli de-epoksidert til zeaxanthin via antheraxanthin. Når lys blir begrensende faktor vil pH stige i lumen i kloroplasten og zeaxanthin re-epoksideres til violaxanthin. VAZ-syklus er plassert i det lyshøstende kompleks i fotosystem I og II. Mengden xanthofyll i forhold til klorofyll øker når plantene vokser ved høyere lysintensitet.
Singlett oksygen i vann
I humusrike vann er det mange nedbrytningsprodukter fra organisk materiale som kan motta lysenergi og delta i produksjonen av singlett oksygen.
Oksygenradikaler og aldring
Alt levende liv begynner å eldes fra det øyeblikk det fødes. Det vi forbinder med aldring hos planter er at grønnfarget klorofyll forsvinner og bladene blir gule. Plantene viser stor variasjon i hvor raskt aldringen skjer. Vårskrinneblom (Arabidopsis thaliana) spirer, blomstrer, setter frø og dør i løpet av 30 dager. Den andre ytterligheten er urfuru (Pinus aristata) som blir nesten 5000 år gammel. Toppaldring kalles fenomenet hvis de overjordiske delene av en plante dør, mens røtter og rotstokk overlever. Hos løvtrær og busker er det sesongvariasjoner i aldringen.
Levealderen til ettårige planter kan forlenges ved å fjerne blomster, frukt og frø. Det er velkjent at blomstringen hos en plante kan forlenges ved at fjerne visne blomster før de dør og danner frukt. Dette betyr at aldring er koblet til indre signaler ved blomstring og frøproduksjon. Men også miljøet påvirker. Dyrkes en kortdagsplante under lange dager eller en kuldekrevende plante ved høy temperatur utsettes aldringen. De delene av planten som skal sikre at planten overlever som art har monopol på næringstilførselen. Dette gjelder både de vegetative deler (rotstokk) og frøene. Aldring relatert til akkumulering av produkter fra malondialdehyd (MDA). MDA er et giftig, ikke nedbrytbart produkt fra friradikal fettperoksidering. MDA danner kompleks med DNA og organisk stoff som akkumuleres. MDA lager også kryssbindinger med proteiner Oksygenradikaler deltar i aldringsprosessen. Ultrafiolett lys og radioaktiv stråling er også med å gi aldringsfenomener. Cytokininer, ungdomshormonene i plantene, er en gruppe stoffer som stopper og forsinker aldring. Aldringshormonet i planter er eten. Plantene sørger for modning av frukt og bær og kvitter seg med bladene om høsten. Dette er styrte aldringsprosesser hvor aldringshormonet eten deltar. Det siste trinnet i biosyntesen av eten fra en syklisk aminosyre (1-amino-cyklopropran 1- karboksylsyre) er katalysert av oksygenradikaler.
I en frøbank i jorda kan frø holde seg levende inntil 10.000 år (Lathyrus arcticus) hvis frøskallet er hardt og lite gjennomtrengelig for oksygen og det oppbevares kaldt. En annen teori for aldring er telomere på kromosomene som virker som et mitotisk timeglass.
Lipoksygenase og peroksidering av fettsyrer
Lipoksygenaser er en gruppe enzymer som er vanlig forekommende hos planter. De katalyserer følgende reaksjoner:
Lipoksygenaser er en type enzymer som gir peroksidering av fettsyrer. Hos dyr deltar lipoksygenase i syntesen av prostaglandiner fra umettede fettsyrer. Hos planter deltar de bl. a. i syntesen av jasmonat fra umettet linolensyre. Små mengder av Fe -og Cu-ioner sammen med fettsyreperoksider kan gi opphav til epoksider, C=O-forbindelser og hydrokarboner som f.eks. etan.

Litteratur:
Halliwell, B. & J.M.C. Gutteridge: Free Radicals in Biology and Medicine. Clarendon Press- Oxford 1989.
Oxygen Radicals in Biological Systems. Methods in Enzymology 105 (1984). Academic Press.
Fenton, H.J.H.: Oxidation of tartaric acid in the presence of iron. J. Chem. Soc. Trans. 65 (1894) 899-910.